II TRIMESTRE
Plan Trimestral #2
1. La medicion en la Quimica y su uso para la Resolucion de Problemas
-El Sistema Internacional de Unidades de Medidas:
| Magnitud física básica | Símbolo dimensional | Unidad básica | Símbolo de la unidad | Definición | ||||
|---|---|---|---|---|---|---|---|---|
| Longitud | L | metro | m | Longitud que en el vacío recorre la luz durante un 1/299 792 458 de segundo. | ||||
| Masa | M | kilogramonota 2 | kg | Masa de un cilindro de diámetro y altura 39 milímetros, aleación 90 % platino y 10 % iridio, custodiado en laOficina Internacional de Pesas y Medidas, en Sèvres, Francia. Aproximadamente la masa de un litro de agua pura a 14,5 °C o 286,75 K. | ||||
| Tiempo | T | segundo | s | Duración de 9 192 631 770 periodos de la radiación de transición entre los dos niveles hiperfinos del estado fundamental del átomo de cesio 133. | ||||
| Corriente eléctrica | I | ampere o amperio | A | Un amperio es la intensidad de una corriente constante que manteniéndose en dos conductores paralelos, rectilíneos, de longitud infinita, de sección circular despreciable y situados a una distancia de un metro uno de otro en el vacío, produciría una fuerza igual a 2·10−7 newtons por metro de longitud. | ||||
| Temperatura | Θ | kelvin | K | 1/273,16 de la temperatura termodinámica del punto triple del agua. El cero de la escala Kelvin coincide con el cero absoluto (−273,15 grados Celsius2 ). | ||||
| Cantidad de sustancia | N | mol | mol | Cantidad de materia que hay en tantas entidades elementales como átomos hay en 0,012 kg del isótopocarbono-12. Si se emplea el mol, es necesario especificar las unidades elementales: átomos, moléculas,iones, electrones u otras partículas o grupos específicos de tales partículas.
Véase masa molar del átomo de 12C a 12 gramos/mol. Véase número de Avogadro. |
||||
| Intensidad luminosa | J | candela | cd | Intensidad luminosa, en una dirección dada, de una fuente que emite una radiación monocromática de frecuencia 5,4·1014 Hz y cuya intensidad energética en dicha dirección es 1/683 vatios por estereorradián.
Véanse lumen, lux, iluminación física. |
-Magnitudes Fundamentales y Derivadas
*Masa, Temperatura, Longitud, Cantidad de Sustancia (Mol)
*Volumen, Densidad, Presión
*Aplicaciones de Factores de Convercion:
| Magnitud física que se toma como fundamental | Unidad básica o fundamental | Símbolo de la unidad |
|---|---|---|
| Longitud ( L ) | metro | m |
| Masa ( M ) | kilogramo | kg |
| Tiempo ( T ) | segundo | s |
| Temperatura ( Θ ) | kelvin | K |
| Intensidad de corriente eléctrica ( I ) | amperio | A |
| Cantidad de sustancia ( μ ) | mol | mol |
| Intensidad luminosa ( Iv ) | candela | cd |
y las derivadas son:
2. Estructura Atomica y Distibucion Electronica
El conocimiento de la estructura electrónica nos permite interpretar las semejanzas y diferencias entre las propiedades químicas de los elementos. Además la mayoría de las reacciones químicas implican una reorganización de la estructura electrónica externa de los átomos. En este capítulo iniciaremos el estudio de los modelos atómicos que permiten conocer la distribución de los electrones en los átomos; desde el modelo de Thomson, pasando por el modelo de Bohr hasta llegar al modelo atómico propuesto por la mecánica cuántica, modelo que es el aceptado actualmente. Destacaremos la descripción de los electrones a través de los números cuánticos y los orbitales electrónicos.
2.1. Reseña Historica de los Modelos Atomicos
-Teoria de Dalton: En 1808 Dalton formuló la teoría atómica, teoría que rompía con todas las ideas tradicionales derivada de los antiguos filósofos griegos (Demócrito, Leucipo).
Este Introduce la idea de la discontinuidad de la materia, es decir, es la primera teoría científica que considera que la materia está dividida en átomos. Los postulados básicos de esta teoría son:
• La materia está dividida en unas partículas indivisibles e inalterables llamadas átomos.
• Los átomos son partículas muy pequeñas y no se pueden ver a simple vista.
• Todos los átomos de un mismo elemento son iguales entre sí, igual masa e iguales propiedades.
• Los átomos de distintos elementos tienen distinta masa y distintas propiedades.
• Los compuestos se forman cuando los átomos se unen entre sí, en una relación constante y sencilla.
• En las reacciones químicas los átomos se separan o se unen; pero ningún átomo se crea ni se destruye, y ningún átomo de un elemento se convierte en átomo de otro elemento.
• Esta concepción se mantuvo casi durante un siglo
-Descubrimiento de las Particulas subatomicas Fundamentales: A. Becquerel descubrió la radioactividad natural, lo que le llevó a deducir la existencia de 3 clases de partículas: los rayos alfa (carga positiva), los rayos beta (carga negativa), y los rayos gamma (carga neutra).
Esto sugería que los átomos no debían de ser partículas indivisibles: descubrimiento de las partículas subatómicas.
El electrón
Se comenzó a estudiar la conductividad de gases a baja presión en un tubo de descarga. Esto reveló una luminiscencia en la pared opuesta al cátodo, luminiscencia que era creada por un chorro de partículas con carga negativa que parecía provenir del cátodo: descubrimiento de los rayos catódicos.
Los rayos catódicos son partículas/radiaciones que se alejan del cátodo en línea recta, y proyectan la sombra del ánodo en el otro extremo. Tienen carga negativa y un contenido energético grande.
Los rayos catódicos obtenidos con gases diferentes son iguales entre sí, y en todos los casos tienen una relación carga/masa idéntica. Thomson le dió valor a esa relación.
Q/m=-1,76x1011 CKg-1
-Modelos Atomicos:
Desde la Antigüedad, el ser humano se ha cuestionado de qué estaba hecha la materia. Unos 400 años antes de Cristo, el filósofo griego Demócrito consideró que la materia estaba constituida por pequeñísimas partículas que no podían ser divididas en otras más pequeñas. Por ello, llamó a estas partículas átomos, que en griego quiere decir "indivisible". Demócrito atribuyó a los átomos las cualidades de ser eternos, inmutables e indivisibles. Sin embargo las ideas de Demócrito sobre la materia no fueron aceptadas por los filósofos de su época y hubieron de transcurrir cerca de 2200 años para que la idea de los átomos fuera tomada de nuevo en consideración |
-J. J. Thompson:Posteriormente, en el año 1897 se descubre el electrón, una de las partículas subatómicas que conforma el átomo. En 1898 Thomson propuso un modelo atómico que tomaba en cuenta la existencia de dicha partícula subatómica. Su modelo era estático, ya que suponía que los electrones estaban en reposo dentro del átomo, y que el conjunto era eléctricamente neutro.
El modelo de Thomson era parecido a un pastel de frutas: los electrones estaban incrustados en una masa esférica de carga positiva. La carga negativa total de los electrones era la misma que la carga total positiva de la esfera, por lo que dedujo que el átomo era neutro.
Thomson también explicó la formación de iones, tanto positivos como negativos.
Cuando el átomo pierde algún electrón, la estructura queda positiva y se forman iones positivos; pero si el átomo gana algún electrón, la estructura queda negativa y se forman iones negativos.
-E. Rutherford:Tras el descubrimiento del Protón, Rutherford formuló su modelo atómico.
En 1911, Rutherford empleó las partículas alfa para determinar la estructura interna de la materia. A partir de ese experimento dedujo que:
• La mayoría de las partículas atraviesan la lámina sin desviarse (99,9%).
• Algunas partículas se desvían (0,1%).
Al ver que no se cumplía el modelo propuesto por Thomson, Rutherford formuló el modelo nuclear del átomo. Según este modelo, el átomo está formado por un núcleo y una corteza:
• Núcleo: aquí se concentra casi la totalidad de la masa del átomo, y tiene carga positiva.
• Corteza: está formada por los electrones, que giran alrededor del núcleo describiendo órbitas circulares (sistema solar en miniatura)
Así mismo, también dijo que la materia es neutra, ya que la carga positiva del núcleo y la negativa de la corteza se neutralizan entre sí.
Rutherford dedujo que:
• La materia está casi vacía; el núcleo es 100.000 veces más pequeño que el radio del átomo.
• La mayoría de las partículas alfa no se desvían porque pasan por la corteza, y no por el núcleo.
• Las que pasan cerca del núcleo se desvían porque son repelidas.
• Cuando el átomo suelta electrones, el átomo se queda con carga negativa, convirtiéndose en un ión negativo; pero si, por el contrario, el átomo gana electrones, la estructura será positiva y el átomo se convertirá en un ión negativo.
• El átomo es estable.
-Teoria Cuantica:
La teoría cuántica, es una teoría física basada en la utilización del concepto de unidad cuántica para describir las propiedades dinámicas de las partículas subatómicas y las interacciones entre la materia y la radiación. Las bases de la teoría fueron sentadas por el físico alemán Max Planck, que en 1900 postuló que la materia sólo puede emitir o absorber energía en pequeñas unidades discretas llamadas cuantos. Otra contribución fundamental al desarrollo de la teoría fue el principio de incertidumbre, formulado por el físico alemán Werner Heisenberg en 1927, y que afirma que no es posible especificar con exactitud simultáneamente la posición y el momento lineal de una partícula subatómica. -Max Planck
-N. Bohr:Tras el descubrimiento del neutrón, en 1913 Böhr intentó mejorar el modelo atómico de Rutherford aplicando las ideas cuánticas de Planck a su modelo. Para realizar su modelo atómico se valió del átomo de hidrógeno; describió el átomo de hidrógeno con un protón como núcleo y con un electrón girando a su alrededor.Las nuevas ideas sobre la cuantización de la energía son las siguientes:
• El átomo está cuantizado, ya que solo puede poseer unas pocas y determinadas energías.
• El electrón gira en unas órbitas circulares alrededor del núcleo, y cada órbita es un estado estacionario que va asociado a un numero natural, "n" (núm. cuántico principal), y toma valores del 1 al 7.
• Así mismo, cada nivel "n" está formado por distintos subniveles, "l". Y a su vez, éstos se desdoblan en otros (efecto Zeeman), "m". Y por último, hay un cuarto núm. cuántico que se refiere al sentido, "s".
• Los niveles de energía permitidos son múltiplos de la constante de planck.
• Cuando un electrón pasa de un nivel de energía a otro, se absorbe o se emite energía. Cuando el electrón está en n=1 se dice que está en el nivel fundamental (nivel de mínima energía); al cambiar de nivel el electrón absorbe energía y pasa a llamarse electrón excitado.
• Böhr situó a los electrones en lugares exactos del espacio.
• Es el modelo planetario de Böhr.
2.2.Estructura Atomica & Distribucion Electronica
-Simbolos Atomicos -Numero Atomico -Numero de Masa

-Isotopos:
|
|
| Para representar un isótopo, hay que indicar el número másico (A) propio del isótopo y el número atómico (Z), colocados como índice y subíndice, respectivamente, a la izquierda del símbolo del elemento. |
*Definicion de Isotopos estables & Reactivos: ESTABLES:Un elemento químico que tiene uno o varios isótopos, de los cuales todos, algunos, o ninguno, pueden ser isotopos estables. Los isótopos que no son estables (radioisótopos), a diferencia de los estables, se desintegran para dar lugar a otros nucleidos emitiendo partículas o radiación electromagnética.
Por ejemplo, el tecnecio no tiene ningún isótopo estable mientras que el estaño tiene diez isótopos estables.
Se conocen unos 2500 nucleidos, de los cuales son estables menos de 300. La representación del número de neutrones (N) frente al número de protones (número atómico, Z) indicándose los isótopos estables se denomina carta de Segrè (diseñada por el físico Emilio Segrè).
REACTIVOS: Se llama radioisótopo o radionucleido a aquel isótopo que es radiactivo. La palabra isótopo, del griego "en mismo sitio", se usa para indicar que todos los tipos deátomos de un mismo elemento químico se encuentran en el mismo sitio de la tabla periódica. Los átomos que son isótopos entre sí, son los que tienen igual número atómico (número de protones en el núcleo), pero diferente número másico (suma de número de neutrones y el de protones en el núcleo). Los distintos isótopos de un elemento, difieren pues en el número de neutrones. Hay varios tipos de isótopos los cuales aún no tienen un nombre fijo ya que cambian constantemente
*Abundancia isotopica:
Son llamados “isótopos” cada una de las variedades de un átomo de cierto elemento químico, los cuales varían
en el núcleo atómico. El núcleo presenta el mismo número atómico (Z), constituyendo por lo tanto el mismo elemento, pero presenta distinto número másico (A) Dicho en otras palabras, los diferentes átomos de un mismo elemento, a pesar de tener el mismo número de protones y electrones (+ y -), pueden diferenciarse en el número de neutrones. Puesto que el número atómico es equivalente al número de protones en el núcleo, y el número másico es la suma total de protones y neutrones en el núcleo, los isótopos del mismo elemento sólo difieren entre ellos en el número de neutrones que contienen. Los elementos, tal como se encuentran en la naturaleza, son una mezcla de isótopos. La masa atómica que aparece en la tabla periódica es el promedio de todas las masas isotópicas naturales, de ahí que mayoritariamente no sean Un átomo no puede tener cualquier cantidad de neutrones. Hay combinaciones "preferidas" de neutrones y protones, en las cuales las fuerzas que mantienen la cohesión del núcleo parecen balancearse mejor. Los elementos ligeros tienden a tener tantos neutrones como protones; los elementos pesados aparentemente necesitan más neutrones que protones para mantener la cohesión. Los átomos con algunos neutrones en exceso o no los suficientes, pueden existir durante algún tiempo, pero son inestables. Los átomos inestables son radioactivos: sus núcleos cambian o se desintegran emitiendo radiaciones .Los estudios sobre la diferenciación de la estructura de los núcleos atómicos comenzaron junto con el siglo XX .Los experimentos realizados indicaban que las sustancias radiactivas químicamente inseparables podrían diferenciarse sólo en su núcleo. En 1912, Sir Joseph Thomson, físico británico, demostró que algunos isótopos son estables. Su experiencia consistió en pasar neón (Ne) a través de un tubo luminoso y desviando los iones de neón mediante campos eléctricos y magnéticos; esto demostró que el neón existe en más de una forma. Fue así como Thomson encontró dos isótopos del neón: Ne-20 y Ne-2
-Numeros Cuanticos: son unos números asociados a magnitudes físicas conservadas en ciertos sistemas cuánticos. Corresponden con los valores posibles de aquellos observables que conmutan con el Hamiltoniano del sistema. Los números cuánticos permiten caracterizar los estados estacionarios, es decir los estados propios del sistema.
En física atómica, los números cuánticos son valores numéricos discretos que indican las características de los electrones en los átomos, esto está basado en la teoría atómica de Niels Bohr que es el modelo atómico más aceptado y utilizado en los últimos tiempos por su simplicidad.
3.Tabla Periodica, Periodicidad & Propiedades Periodicas: PERIODICIDAD Y PROPIEDADES PERIÓDICAS
Los elementos se encuentran ordenados en una tabla periódica en orden ascendente del número atómico tomando en cuenta la ley periódica que dice que cada cierto número de elementos las propiedades periódicas se repiten . Los elementos se ordenan en periodos, en forma horizontal, y en grupos en forma vertical.
Los elementos de un mismo grupo poseen propiedades químicas y físicas similares. Esto se debe a que tienen la misma estructura electrónica terminal.
Por ejemplo la configuración electrónica de los elementos del grupo I termina en ns1, la del grupo VI en ns2 np4 .
Los elementos se dividen en tres grandes grupos que son : Representativos, transición y tierras raras. Esta clasificación depende de la posición del electrón diferenciante de cada elemento. Los elementos representativos poseen su electrón diferenciante en los subniveless y p, los de transición en d y las tierras raras en f
Existen grupos de tres elementos que repiten sus propiedades en forma horizontal. Estos elementos se denominan triadas y son elementos de transición. Las triadas son Fe,Co y Ni ;
Ru, Rh y Pd; Os ,Ir y Pt.
Además los elementos se clasifican como metales y no-metales. Esta clasificación se denota en la tabla periódica con una línea punteada. Los metales son todos elementos sólidos con excepción del mercurio que es líquido. Los no-metales existen en los tres estados de agregación siendo el bromo un líquido. Los elementos a ambos lados de la línea punteada se denominan metaloides ya que poseen propiedades de metales y no-metales, como por ejemplo el Al , Si, Ge y As.
-Antecedentes Historicos
*Triadas de Dobereiner: A principios del siglo XIX, se conocían la suficiente cantidad de elementos y compuestos como para que fuese necesario hacer una clasificación con el fin de facilitar su comprensión y estudio.
Desde el principio se supo de la existencia de familias de elementos que compartían propiedades y semejanzas entre sí, intuyéndose que debía de existir una ley natural que tendiese a agrupar y relacionar con lógica a los elementos. La búsqueda de esta ley está llena de intentos, como las Triadas de Döbereiner , las octavas de Newlands, el tornillo telúrico de Charcourtois, etc, todos ellos basados generalmente en dos criterios fundamentales:
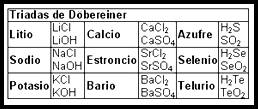
1. La similitud de las propiedades fisicoquímicas de los elementos
2. La relación entre las propiedades y alguna característica atómica como la masa atómica.
Muchos de los intentos por encontrar una forma de agrupación o clasificación de los elementos, ya sea por su originalidad o por su éxito merecen un reconocimiento, y este es el caso de las Triadas de Döbereiner.
*Octavas de Newlands: El químico inglés Jhon Alexander Reina Newlands, propuso el ordenamiento de los elementos, según el orden creciente de sus masas atómicas, dando un gran paso en la correcta clasificación de los elementos.
Newlands dispuso a los elementos en filas horizontales de 7 en 7, resultando periodos en que el octavo elemento se parecía en propiedades al primero; el noveno al segundo; el décimo al tercero y así sucesivamente. Por lo cual los que tengas propiedades semejantes tienen que quedar en la misma columna.

Si consideramos como “primer elemento” al nitrógeno de la serie primera; entonces el “octavo elemento” (Dentro de la segunda serie) sería el fósforo; luego “N” y “P” deben tener propiedades semejantes. Pero si esta vez, nuestro “primer elemento” es el cloro, entonces para llegar al “octavo elemento” (que tenga propiedades semejantes) deberíamos considerar que la tercera serie esté constituida por 14 elementos (el Br seria nuestro octavo elemento), lo que significa que incumple con la ley de las Octavas.
Actualización 1 (31/10/2013)
*Tabla Periodica de Mendeleiev: Basándose en la hipótesis de que las propiedades de los elementos son función periódica de sus pesos atómicos, Dmitri Mendeléyev publicó en el año 1869 unatabla periódica en la que situó todos los elementos conocidos en aquella época, ordenando los elementos de forma tal que los elementos pertenecientes a una misma familia aparecen en la misma línea horizontal.
| I | II | III | IV | V | VI | ||||||
| . | . | . | Ti = 50 | Zr = 90 | ? = 180 | ||||||
| . | . | . | V = 51 | Nb = 94 | Ta = 182 | ||||||
| . | . | . | Cr = 52 | Mo = 96 | W = 186 | ||||||
| . | . | . | Mn = 55 | Rh = 104,4 | Pt = 197,4 | ||||||
| . | . | . | Fe = 56 | Ru = 104,4 | Ir = 198 | ||||||
| . | . | . | Ni = Co = 59 | Pd = 106,6 | Os = 199 | ||||||
| H = 1 | . | . | Cu = 63,4 | Ag = 108 | Hg = 200 | ||||||
| . | Be = 9,4 | Mg = 24 | Zn = 65,4 | Cd = 112 | . | ||||||
| . | B = 11 | Al = 27,4 | ? = 68 | Ur = 116 | Au = 197? | ||||||
| . | C = 12 | Si = 28 | ? = 70 | Sn = 118 | . | ||||||
| . | N = 14 | P = 31 | As = 75 | Sb = 122 | Bi = 210 | ||||||
| . | O = 16 | S = 32 | Se = 79,4 | Te = 128? | . | ||||||
| . | F = 19 | Cl = 35,5 | Br = 80 | J = 127 | . | ||||||
| Li = 7 | Na = 23 | K = 39 | Rb = 85,4 | Cs = 133 | Tl = 204 | ||||||
| . | . | Ca = 40 | Sr = 87,6 | Ba = 137 | Pb = 207 | ||||||
| . | . | ? = 45 | Ce = 92 | . | . | ||||||
| . | . | ?Er = 56 | La = 94 | . | . | ||||||
| . | . | ?Yt = 60 | Di = 95 | . | . | ||||||
| . | . | ?In = 75,6 | Th = 118? | . | . |
El descubrimiento del helio causó a Mendeléyev una gran contrariedad, ya que este nuevo elemento no tenía un lugar adecuado para colocarse en la Tabla, pero en el fondo fue una brillante confirmación de la ley periódica ya que el helio, junto con los demás gases nobles descubiertos más tarde, constituyeron el grupo 0.
*Ley Periodica de Moseley: Propone el criterio de ordenamiento, de los elementos químicos con base en el número atómico y enuncia la ley periódica moderna:
|
*Tabla Periodica Actual: La historia de la tabla periódica está íntimamente relacionada con varios aspectos del desarrollo de la química y la física:
- El descubrimiento de los elementos de la tabla periódica.
- El estudio de las propiedades comunes y la clasificación de los elementos.
- La noción de masa atómica (inicialmente denominada "peso atómico") y, posteriormente, ya en el siglo XX, de número atómico.
- Las relaciones entre la masa atómica (y, más adelante, el número atómico) y las propiedades periódicas de los elementos
